瑞德西韦临床试验:“希望”的困局
作者:董冀宁
2020-03-11·阅读时长12分钟
本文需付费阅读
文章共计6288个字,产生6条评论
如您已购买,请登录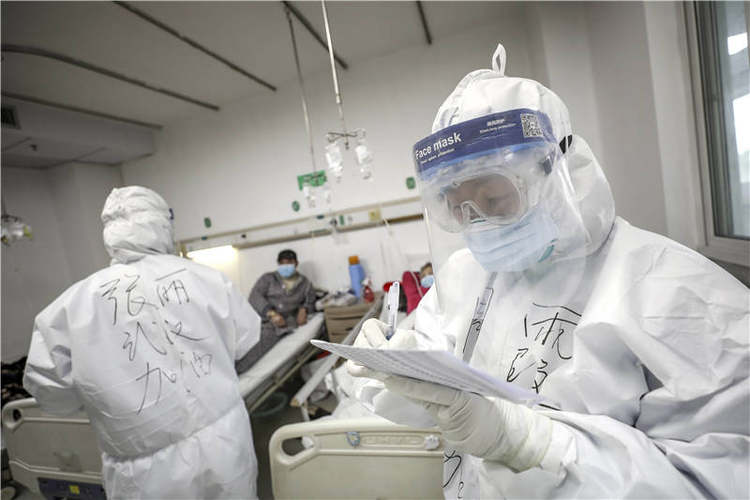
因为新冠肺炎病房对外隔离, 因此除了送至外界检测的标本外,其他数据主要依靠一线医务人员记录。图为金银潭医院(远征 摄)
记者/董冀宁 严岩
已经无从考证究竟是谁根据瑞德西韦的英文Remdesivir音译出“人民的希望”。但是从2月5日,第一批2843盒瑞德西韦通过海关进入中国之后,作为“最有希望的特效药”,它就一直牵动着公众的神经。
早在今年1月31日,美国华盛顿州新冠肺炎病例团队在《新英格兰医学杂志》(NEJM)发表论文,称美国首例新冠肺炎患者在入院7天后,基于“同情用药”的原则,使用尚处在临床试验阶段的瑞德西韦静脉输注以后,原本明显恶化的病情好转。
中国国家药监局在48小时内紧急批准瑞德西韦在中国用于两项新冠肺炎临床试验研究。美国家立医学图书馆(NLM)运营的ClinicalTrials.gov临床试验数据库显示,从2月6日开始,武汉金银潭医院和北京中日友好医院分别开展了两项针对轻、中症患者和重症患者的招募计划,并进行试验组和对照组双盲临床试验,治疗周期分别为5天和10天。研究结果预计4月27日揭盲。
但这项被寄予厚望的药物试验,却遭遇到患者招募的困境。早在2月15日,瑞德西韦临床试验开展9天之后,科技部生物技术发展中心主任张新民在国务院联防联控机制召开的新闻发布会上介绍,仅有168例重症病人和17例轻症病人进入瑞德西韦的临床试验。11天后,研发瑞德西韦的药企吉利德科学(Gilead Science)的病毒学副总裁席纳(Tomas Cihlar)在一场线上论坛中透露,目前中国实际招募数约为计划招募的三分之一。
3月5日,瑞德西韦中国临床试验项目的总负责人,北京中日友好医院副院长曹彬在接受采访时首次公开了瑞德西韦(Remdesivir)两项临床试验的入组人数:轻、中症患者入组64例,重症入组233例。而按照该药物公开的临床试验设计方案,一切顺利的话,满足统计学标准的计划入组人数应分别为308例与452例。
此时距离首批瑞德西韦药物运抵国内,并开展临床研究已过去了整整一个月。在这一个月内,疫情的发展趋于稳定,整体患者数量在减少——进入3月后,连续好几天除武汉外全国其他城市的新增病例已是个位数。对于一款新药来说,临床试验阶段必须要完成足够多的病例研究,药物的安全性和有效性被充分验证,最终才能获批上市。2003年的SARS之所以没有针对性的特效药研发出来,与疫情后期没有足够多的病人完成Ⅲ期临床有关。因而,对瑞德西韦来说,疫情的平稳和好转却提出了一个新的难题——留给药企和研究人员的时间已经不多了。
文章作者


董冀宁
发表文章14篇 获得14个推荐 粉丝27人
爱是永恒
收录专栏
现在下载APP,注册有红包哦!
三联生活周刊官方APP,你想看的都在这里





